Sắt sunphat là dạng muối phổ biến của sắt với công thức hóa học là FeSO4, có nhiều ứng dụng trong sản xuất phân bón và tham gia nhiều phản ứng hóa học. Cùng LabVIETCHEM tìm hiểu về hóa chất FeSO4 là chất gì? Feso4 màu gì? Có kết tủa không? Công thức hóa học? Tính chất và ứng dụng qua bài viết dưới đây nhé.
Sắt sunphat là hợp chất muối vô cơ, tồn tại dưới dạng bột hoặc tinh thể với công thức hóa học: FeSO4.
Thông thường, nó thường tồn tại dưới dạng ngậm 7 nước với công thức là FeSO4.7H20.
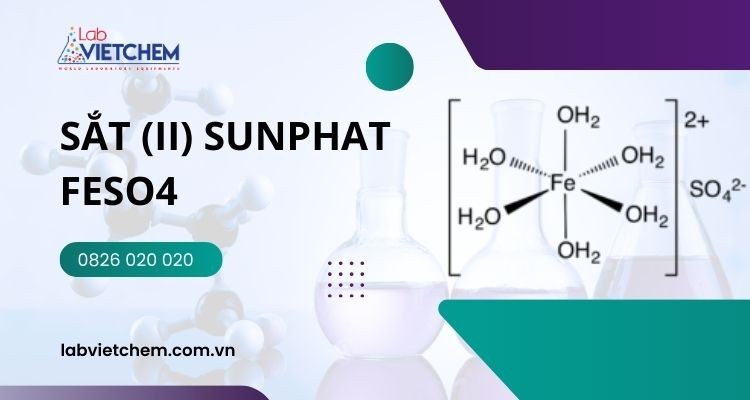
Cấu tạo của FeSO4.xH20
Có rất nhiều tên gọi khác nhau về Sắt sunphat như: Sắt(II) sulfate, Ferơ sulfat, vitriol xanh lục, vitriol sắt, iron (II) sulfate, Copperas, phèn sắt,...
Hóa chất này được ứng dụng rộng rãi trong các lĩnh vực của đời sống như là thành phần trong sản xuất phân bón, xử lý nước thải hay làm tiền thân của nhiều hợp chất sắt khác…
Sắt sunphat tồn tại dưới dạng bột hoặc tinh thể không màu, có màu vàng nhạt hoặc màu xanh tùy thuộc lượng nước có trong công thức. Cụ thể:
- Đối với dạng khan: Ở dạng tinh thể không màu.
- Dạng ngậm 1 nước: FeSO4.H20 ở dạng tinh thể vàng nhạt.
- Dạng ngậm 7 nước: FeSO4.7H20 là các hạt tinh thể màu lục lam sáng.

FeSO4 có màu gì?
FeSO4 có thể kết hợp với hợp chất khác để tạo ra các phức chất màu, chẳng hạn như:
- Tạo phức chất với NH3:
+ FeSO4·2NH3·H2O: Bột màu nâu đen.
+ FeSO4·5NH3·H2O: Tinh thể màu đỏ nâu.
+ FeSO4·6NH3: Bột màu trắng.
- Tạo phức với hợp chất N2H4 tạo thành FeSO4·2N2H4·H2O ở dạng tinh thể lục phương màu lục nhạt.
- Tạo phức với CON3H5 tạo ra FeSO4·2CON3H5 là tinh thể màu trắng.
- Tạo phức với CS(NH2)2, tạo ra FeSO4·2CS(NH2)2 là tinh thể không màu.
- Tạo phức với CSN3H5 ra FeSO4·2CSN3H5 là các tinh thể màu lục.
|
Tính chất |
Dạng khan (FeSO4) |
Dạng ngậm 1 nước (FeSO4. H2O) |
Dạng ngậm 7 nước (FeSO4. 7H2O) |
|
|
Ngoại quan |
Tinh thể không màu |
Tinh thể vàng nhạt |
Tinh thể lục lam sáng |
|
|
Mùi |
Không mùi |
|||
|
Khối lượng riêng |
3,65 g/cm³ |
3 g/cm³ |
1,895 g/cm³ |
|
|
Khối lượng phân tử |
151,9106 g/mol |
169,92588 g/mol |
278,01756 g/mol |
|
|
Nhiệt độ nóng chảy |
680 °C tương ứng 953 K hoặc 1.256 °F |
300 °C tương ứng 572 °F hoặc 573 K |
60–64 °C ứng 140–147 °F hoặc 333–337K |
|
|
Độ hòa tan |
Trong nước |
- Tại 77 độ C: 44,69 g/100mL. - Tại 90,1 ℃: 35,97 g/100mL |
- Tại 25℃: 29,51 g/100mL - Tại 54 ℃: 51,35g/100mL |
|
|
Dung môi khác |
- Ít tan trong cồn. - Tạo phức chất với nhiều hợp chất vô cơ và hữu cơ. - Mức độ hòa tan trong ethylen glycol tại 20 độ C: 6,4 g/100 g. |
|||
Thể hiện tính chất đặc trưng của hợp chất muối vô cơ và tính oxi hóa, tính khử, cụ thể như:
- Tính chất hóa học của muối:
+ Tác dụng với axit: Sản phẩm tạo thành là muối mới và axit mới.
2FeSO4 + 2H2SO4đ → Fe2(SO4)3 + SO2 + H2O
+ Phản ứng với dung dịch kiềm, tạo ra muối mới và base mới trong đó có tối thiểu 1 trong 2 chất kết tủa.
FeSO4 + KOH → K2SO4 + Fe(OH)2
+ Phản ứng với muối khác: Trong điều kiện 2 muối mới hình thành phải có ít nhất 1 muối kết tủa.
FeSO4 + BaCl2 → BaSO4 + FeCl2
- Thể hiện tính khử: Phản ứng với khí Cl2, thuốc tím, H2SO4 đặc nóng,...
FeSO4 + Cl2 → FeCl3 + Fe2(SO4)3
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O.
- Thể hiện tính oxi hóa: Phản ứng với kim loại có hoạt động hóa học mạnh hơn Fe.
FeSO4 + Mg → MgSO4 + Fe
Có nhiều phương pháp để điều chế FeSO4, trong đó, cách được sử dụng thông dụng là cho Sắt (II) oxit (FeO) hoặc Sắt (II) hydroxide - Fe(OH)2 phản ứng với axit H2SO4 loãng. Quá trình tạo thành diễn ra theo phản ứng sau:
FeO + H2SO4 → FeSO4 + H2O
Bên cạnh đó, ta có thể điều chế chúng bằng cách cho sắt tác dụng với CuSO4:
Fe + CuSO4 → FeSO4 + Cu↓
- FeSO4 là thành phần được sử dụng trong diệt cỏ, rong rêu.
- Được sử dụng để cải tạo chất lượng đất, làm giảm độ pH đối với những loại đất có độ kiềm cao gây ảnh hưởng tới sự hấp thu các chất dinh dưỡng của cây.
- Ứng dụng để xử lý nhiễm clo sắt.
FeSO4 được biết đến với cái tên khác là phèn sắt, có tác dụng kẹo tụ. Tham gia vào phản ứng oxi hóa giúp loại bỏ photphat trong nước đối của các nguồn nước xử lý nước thải đô thị và công nghiệp.
Chúng ta có thể tìm thấy FeSO4 trong rất nhiều công thức dược phẩm, nó được sử dụng với mục đích bổ sung sắt giúp:
- Phòng ngừa và điều trị thiếu máu do thiếu sắt.
- Kích thích cơ thể sản xuất có tế bào hồng cầu, đảm bảo cơ thể khỏe mạnh.

FeSO4 cung cấp sắt cho cơ thể
- Công nghiệp in ấn, mực: Là thành phần của mực, trước đây nó đã từng được sử dụng để làm đen da.
- Ngành dệt may: Là chất cố định thuốc nhuộm, được sử dụng làm chất gắn màu trong nhuộm len.
- Ứng dụng trong khử cromat trong xi măng thành hợp chất Cr (III) ít độc hơn.
- Chất này có thể ăn mòn một số vật liệu được làm từ sắt, đồng, nhôm,... Do đó không sử dụng các vật liệu này để lưu trữ chúng. Nên bảo quản trong các vật liệu chịu được tính ăn mòn của chúng như thép không rỉ, sợi thủy tinh, bao nhựa…
- Do có tính chất hút ẩm mạnh, cần bảo quản ở nơi khô ráo, thoáng mát tránh những nơi ẩm ướt hoặc những nơi có ánh sáng mặt trời chiếu vào.
- Hãy dán tem cảnh báo nơi đựng hóa chất này.
- Nếu tiếp xúc cần sử dụng găng tay và đồ bảo hộ thích hợp để đảm bảo an toàn.
Với tính ứng dụng rộng rãi của FeSO4, có rất nhiều đơn vị phân phối loại hóa chất này trên thị trường với giá cả và nguồn gốc khác nhau. Một trong những đơn vị mà khách hàng có thể yên tâm lựa chọn đó chính là LabVIETCHEM. Bởi chúng tôi, đáp ứng đủ các tiêu chí sau:
- Đảm bảo chất lượng với đầy đủ hóa đơn, chứng từ.
- Giá thành hợp lý.
- Phân phối đa dạng nhiều loại hóa chất khác nhau, đáp ứng được tiêu chí của khách hàng.
- Giao hàng nhanh chóng, đảm bảo an toàn.
- Sẵn sàng hỗ trợ khách hàng 24/7.
Vì vậy, nếu quý khách hàng có nhu cầu mua sản phẩm hãy liên hệ ngay với chúng tôi qua số hotline 0826 020 020 hoặc truy cập labvietchem.com.vn để biết thêm chi tiết thông tin sản phẩm.
Hỗ trợ

Nguyễn Văn Trọng
Sales Director
094 6688 777
trongnguyen@labvietchem.vn

Cao Thu Hoài
Sales Engineer
0325 290 685
thietbi404@labvietchem.vn

Nguyễn Thúy Hảo
Sales Engineer
0364 841 980
nguyenhao@labvietchem.com.vn

Vũ Thị Thư
Sales Engineer
0326 046 889
vuthu@labvietchem.com.vn

Trần Thị Kim Mỵ
Sales Engineer
0348 140 389
sales@labvietchem.com.vn

Lưu Vân Quỳnh
Trưởng nhóm sinh hóa
0367 631 984
sales@labvietchem.com.vn

Phan Hải Phong
Sales Engineer
0949 966 821
sales@labvietchem.com.vn

Dương Tuấn Anh
Sales Engineer
0329 422 268
sales@labvietchem.com.vn

Hotline
Hóa chất và thiết bị thí nghiệm
0826 050 050
saleadmin806@vietchem.vn

Phạm Quang Phúc
Hóa chất và thiết bị thí nghiệm
0965 862 897
quangphuc@vietchem.vn

Hồ Thị Hoài Thương
Sales Engineer
0967 609 897
kd801@labvietchem.vn

Phạm Thị Nhật Hạ
Sales Engineer
0985 357 897
kd803@vietchem.vn

Vũ Thị Kim Khánh
Sales Engineer
0965 948 897
kd802@vietchem.vn

Trịnh Nhất Hậu
Kỹ thuật
0964 974 897
Service801@labvietchem.com

Trần Phương Bắc
Sales Engineer
0862 009 997
tranphuongbac@labvietchem.com.vn

Nguyễn Hoàng Giáo
Sales Engineer
0939 154 554
kd201@labvietchem.com.vn

Trần Công Sơn
Sales Engineer
090 105 1154
kd201@labvietchem.vn

Tạ Thảo Cương
Sales Engineer
0888851646
kd205@labvietchem.vn

Trần Thị Trúc Lil
Sales Engineer
0325 300 716
kd202@labvietchem.com.vn
Nhận xét đánh giá