Axit là gì? Tính chất vật lý, hóa học như thế nào? Tầm quan trọng của sự cân bằng axit và kiềm trong cơ thể người ra sao? Đó có lẽ là thắc mắc của không ít người, nhất là các bạn học sinh. Hôm nay, LabVIETCHEM sẽ giúp các bạn trả lời những câu hỏi trên. Cùng bắt đầu nhé.

Axit là gì?
- Axit là những hợp chất có chứa một hay nhiều nguyên tử hydro liên kết với gốc axit như HCl, HNO3, H2SO4,…
- Ngoài ra, còn có một định nghĩa khác của axit là nó là một hợp chất mà khi hòa tan vào nước sẽ tạo thành dung dịch có độ pH thấp hơn 7.
- Công thức hóa học tổng quát của axit là HxA, trong đó x là chỉ số của nguyên tử Hydro và A là gốc axit. Khi tách nguyên tử Hydro ra khỏi phân tử hóa học ta sẽ thu về gốc axit. Trong thực tế, gốc axit tồn tại rất nhiều nơi như quả chanh, trái cây,… thậm chí nước mà bạn đang uống hàng ngày khi chưa đi qua hệ thống lọc cũng có chứa các gốc axit.
Có nhiều tiêu chí để phân loại axit như:
- Axit mạnh: Dung dịch tạo thành khi hòa tan axit có độ pH nhỏ hơn 7 và cách xa 7 như HCl, H2SO4,…
- Axit yếu: Dung dịch tạo thành khi hòa tan axit có độ pH nhỏ hơn 7 nhưng gần 7 như H2S, H2CO3,…
- Axit có oxy: H2SO4, HNO3,…
- Axit không có oxy: HCl, HI,…
Ngoài ra, có thể phân thành axit vô cơ (HCl, HNO3,…) và axit hữu cơ (-RCOOH)
- Có vị chua khi tan trong nước.
- Với các axit mạnh, nó có thể gây bỏng khi tiếp xúc với da.
- Khả năng dẫn điện tốt vì nó là chất điện li mạnh.
- Làm giấy quỳ tím chuyển sang màu đỏ.
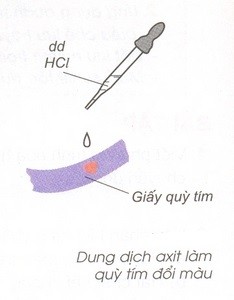
- Tác dụng với kim loại trừ Au, Pt, Cu, Ag tạo thành muối và giải phóng H2. Với axit đặc thì không giải phóng khí H2.
Mg + H2SO4(loãng) → MgSO4 + H2
- Tác dụng với bazo tạo thành muối và nước
Mg(OH)2 + 2HCl → MgCl2+ 2H2O
- Tác dụng với oxit bazo tạo thành muối và nước
FeO + H2SO4(loãng) → FeSO4 + H2O
- Tác dụng với muối tạo thành ít nhất 1 kết tủa hoặc 1 khí.
Muối tan + Axit mạnh → Muối mới (tan hoặc không tan) + axit mới (yếu hoặc dễ bay hơi hoặc mạnh).
H2SO4 + BaCl2 → BaSO4(r) + 2HCl
K2CO3 + 2HCl → 2KCl + H2O + CO2 (H2CO3 phân hủy ra H2O và CO2)
- Axit mạnh phản ứng nhanh với kim loại, với muối cacbonat, là dung dịch dẫn điện tốt,…
- Axit yếu phản ứng chậm với kim loại, với muối cacbonat, là dung dịch dẫn điện kém,…
- Chỉ số pH càng nhỏ thì độ axit càng mạnh và ngược lại. Mỗi độ pH giãm có nghĩa độ axit sẽ tăng 10 lần, giả sử như pH của nước chanh là 2, còn axit trong dạ dày là 1 tức độ axit trong dạ dày mạnh gấp 10 lần nước chanh. Tuy nhiên, thang đo pH giới hạn là 0 nên để đo các axit mạnh, người ta sử dụng thêm thang đo độ axit Hammet.
- Axit có độ pH thấp nhất hiện nay là -31,3. Đó là axit Fluoroantimonic (H2FSbF6) – siêu axit. Axit Fluoroantimonic mạnh gấp 10 lũy thừa 16 (10 triệu tỷ) lần axit sulfuric đậm đặc 100%.
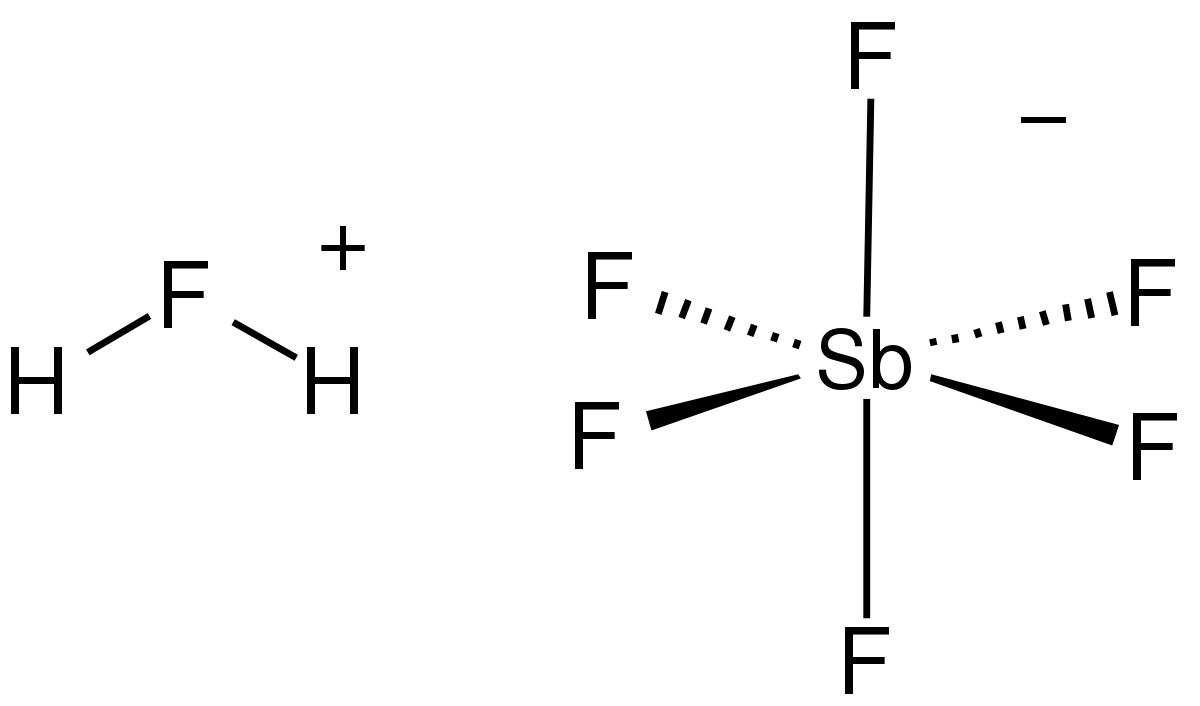
Cấu trúc hóa học của Axit Fluoroantimonic
- Để cất giữ loại axit này, người ta sử dụng polyme tổng hợp Polytetrafluoroethylene PTFE hay Teflon bởi siêu axit này có thể phá hủy gần như tất cả các loại hợp chất hữu cơ, thậm chí cả thùng chứa.

Tầm quan trọng của sự cân bằng axit và kiềm trong cơ thể người
Theo nhiều nghiên cứu khoa học thì môi trường cơ thể con người có tính kiềm với độ pH dao động trong khoảng 7,3 – 7,4. Đồng thời, trong cơ thể con người cũng có thể có tính axit do thói quen ăn uống không lành mạnh, cơ thể không thải được độc. Nguyên tố kiềm di chuyển trong máu, còn nguyên tố tạo axit di chuyển lên não.
Nếu môi trường axit thay đổi, cơ thể có thể mắc một số bệnh như ung thư, tiểu đường, gout, loãng xương,…và lúc này, bạn cần bổ sung các chất có tính kiềm để tái cân bằng lại cơ thể.
Để cân bằng độ axit và kiềm, việc bổ sung nước điện giải ion kiềm hàng ngày là cần thiết. Nước được tạo ra trong quá trình điện phân rất giàu các ion kiềm. Việc uống nước điện giải ion kiềm hàng ngày sẽ giúp bạn bổ sung kiềm cho cơ thể, từ đó giúp trung hòa axit hiệu quả.
Trên đây là một số thông tin về axit là gì? Tầm quan trọng của sự cân bằng axit và kiềm trong cơ thể người mà LabVIETCHEM muốn chia sẻ đến các bạn. Để biết thêm nhiều bài viết hay hơn nữa, vui lòng truy cập website labvietchem.com.vn.
Hỗ trợ

Tống Duy Cương
Director
0915 989 780
DuyCuong@labvietchem.vn

Nguyễn Văn Trọng
Deputy Director
094 6688 777
trongnguyen@labvietchem.vn

Cao Thu Hoài
Sales Engineer
0325 290 685
thietbi404@labvietchem.vn

Nguyễn Thúy Hảo
Sales Engineer
0364 841 980
nguyenhao@labvietchem.com.vn

Trần Thị Kim Mỵ
Sales Engineer
0348 140 389
sales@labvietchem.com.vn

Trịnh Văn Hường
Sales Engineer
0986 768 834
sales@labvietchem.com.vn

Lưu Vân Quỳnh
Trưởng nhóm sinh hóa
0367 631 984
sales@labvietchem.com.vn

Phan Hải Phong
Sales Engineer
0949 966 821
sales@labvietchem.com.vn

Dương Tuấn Anh
Sales Engineer
0329 422 268
sales@labvietchem.com.vn

Hotline
Hóa chất và thiết bị thí nghiệm
0826 050 050
saleadmin806@vietchem.vn

Hồ Thị Hoài Thương
Sales Engineer
0967 609 897
kd801@labvietchem.vn

Phạm Thị Nhật Hạ
Sales Engineer
0985 357 897
kd803@vietchem.vn

Vũ Thị Kim Khánh
Sales Engineer
0965 948 897
kd802@vietchem.vn

Nguyễn Hoàng Giáo
Sales Engineer
0939 154 554
kd201@labvietchem.com.vn

Tạ Thảo Cương
Sales Engineer
0888851646
kd205@labvietchem.vn

Trần Thị Trúc Lil
Sales Engineer
0325 300 716
kd202@labvietchem.com.vn

Trần Dương Thanh
Nhân viên kinh doanh
0964980951
saleadmin201@labvietchem.vn
Nhận xét đánh giá