Hiểu rõ định luật bảo toàn khối lượng sẽ giúp các bạn học sinh dễ dàng giải quyết các bài tập tính toán hóa học. Hãy cùng LabVIETCHEM theo dõi bài viết dưới đây để tìm hiểu chi tiết định luật này để áp dụng một cách hiệu quả nhất nhé.
Định luật bảo toàn khối lượng hay còn được biết đến là định luật Lomonosov – Lavoisier. Đây là một định luật hóa học cơ bản được phát hiện độc lập bởi 2 nhà khoa học thông qua các thí nghiệm được cân đo chính xác. Trong đó:
Định luật đã đưa ra rằng: tổng khối lượng ban đầu của các chất tham gia phản ứng sẽ bằng với tổng khối lượng sản phẩm được tạo thành.

Tìm hiểu định luật bảo toàn khối lượng là gì?
Trong một phản ứng hóa học bất kỳ thì tổng khối lượng các chất tạo nên từ phản ứng sẽ bằng khối lượng của tất cả các chất đã tham gia phản ứng, chúng chỉ được chuyển đổi từ dạng này sang một dạng khác. Hay cũng có thể hiểu là khối lượng trong một hệ cô lập không được tạo nên cũng như sẽ không bị phá hủy vì những phản ứng hóa học hay thay đổi vật lý.
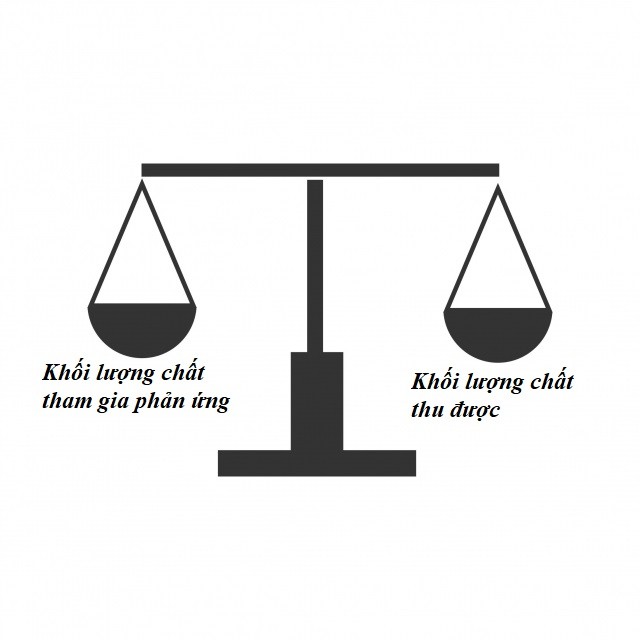
Định luật bảo toàn khối lượng được phát biểu ra sao?
Định luật bảo toàn khối lượng cho ta biết rằng trong mỗi phản ứng hóa học chỉ có sự thay đổi liên quan tới electron, còn số nguyên tử của nguyên tố sẽ vẫn được giữ nguyên cũng như khối lượng các nguyên tử là không đổi. Do đó, khối lượng của các chất sẽ được bảo toàn.

Định luật bảo toàn khối lượng mang đến những ý nghĩa quan trọng
Trong phản ứng với nhiều chất khác nhau, gồm cả chất tham gia và sản phẩm, khi biết được khối lượng của (n-1) chất thì chắc chắn sẽ tính ra được khối lượng chất còn lại.

Với định luật bảo toàn khối lượng, ta sẽ tìm được khối lượng chất còn lại khi biết khối lượng (n-1) chất
Công thức định luật bảo toàn khối lượng có thể được viết như sau:
mA + mB = mC + mD
Trong đó:
Nếu ở một phương trình phản ứng có 2 chất tham gia là A và B, còn chất tạo thành là C và D, đã biết khối lượng của A, B, C thì dựa vào định luật, ta có thể tính được C:
A + B = C + D => C = A + B – D

Bài tập vận dụng giúp dễ dàng ghi nhớ định luật bảo toàn khối lượng
Bài tập 1: Từ 10g canxi cacbonat (CaCO3) tạo ra được 3,8g khí cacbonic (CO2) cùng x gam canxi oxit (CaO). Hãy viết phương trình phản ứng đã xảy ra và tính khối lượng của CaO được tạo thành.
Lời giải:
PTPƯ: CaCO3 → CaO + CO2
Áp dụng định luật ta có:
mCaCO3 = mCaO + mCO2
<=> mCao = mCaCO3 – mCO2 = 10 – 3,8 = 6,2 g
Vậy khối lượng của CaO tạo thành là 6,2g
Bài tập 2: Thực hiện thí nghiệm: Na2SO4 + BaCl2 → BaSO4 + 2NaCl với khối lượng của natri sunfat (Na2SO4) là 14,2g và khối lượng của 2 chất tạo thành: BaSO4 là 23,3g, NaCl là 11,7g. Từ phương trình phản ứng và khối lượng của chất đã ch, hãy tính khối lượng của bari clorua tham gia phản ứng.
Lời giải:
Theo định luật ta có:
=> 23,3 + 11,7 – 14,2 = 20,8 g
Bài tập 3: sau khi hóa tan hoàn toàn 3,9g kali vào trong 36,2g nước thu được dung dịch có nồng độ bao nhiêu?
Lời giải:
PTPƯ: 2K + 2H2O → 2KOH + H2
Khối lượng dung dịch (mdung dịch) = mkali + mnước – mkhí hidro
=> 3,9 + 36,2 – 0,05 x 2 = 40g
Nồng độ của dung dịch là: C%KOH = (0,1 x 56 x 100%)/ 40 = 14%
Bài tập 4: Khi điện phân dung dịch chứa hỗn hợp KCl và CuSO4 với điện cực trơ đến khi xuất hiện khí thoát ra ở cả hai điện cực thì dùng lại, có 448 ml khí (ở đktc) thoát ra ở anot. Dung dịch sau quá trình điện phân có thể hòa tan tối đa 0,8g MgO. Vậy khối lượng của dung dịch sau khi điện phân đã giảm bao nhiêu gam (biết lượng H2O bay hơi là không đáng kể)
Lời giải:
PTPƯ:
CuSO4 + 2KCl → Cu + Cl2 + K2SO4 (1)
0,01 ← 0,01
Dung dịch sau điện phân hòa tan là MgO – dung dịch axit, đồng nghĩa sau phản ứng (1) CuSO4 dư
PTPƯ:
2CuSO4 + 2H2O → 2Cu + O2 + H2SO4
nCl2 + nO2 = 0,02
H2SO4 + MgO → MgSO4 + H2O
Khối lượng dung dịch sẽ giảm:
mdung dịch giảm = mcu + mCl2 + mO2
=> 0,03 x 64 + 0,01 x 71 + 0,01 x 32 = 2,95g
Bài tập 5: dùng dung dịch HCl dư hòa tan hoàn toàn 8,9g hỗn hợp 2 kim loại (ở đktc). Sau khi cô cạn dung dịch vừa thu được sau phản ứng thì lượng muối khan thu được là bao nhiêu?
Lời giải:
Gọi công thức chung của 2 kim loại trên là M, hóa trị n, ta có:
2M + 2nHCl → 2MCln + nH2
Theo công thức định luật bảo toàn khối lượng:
mkim loại + mHCl = mmuối + mH2
mmuối = 8,9 + 0,4 x 36,5 – 0,2 x 2 = 23,1g
Trên đây là một số thông tin liên quan đến định luật bảo toàn khối lượng mà LabVIETCHEM đã tổng hợp lại. Hy vọng với nội dung bài viết trên cùng những bài tập ứng dụng đã giúp bạn đọc hiểu rõ khái niệm, ứng dụng của định luật này. Hãy liên hệ với chúng tôi qua hotline 0826 020 020 hoặc nhắn tin trên website labvietchem.com.vn nếu bạn còn vướng mắc bất cứ vấn đề nào liên quan nhé.
Hỗ trợ

Tống Duy Cương
Director
0915 989 780
DuyCuong@labvietchem.vn

Nguyễn Văn Trọng
Deputy Director
094 6688 777
trongnguyen@labvietchem.vn

Cao Thu Hoài
Sales Engineer
0325 290 685
thietbi404@labvietchem.vn

Nguyễn Thúy Hảo
Sales Engineer
0364 841 980
nguyenhao@labvietchem.com.vn

Trần Thị Kim Mỵ
Sales Engineer
0348 140 389
sales@labvietchem.com.vn

Trịnh Văn Hường
Sales Engineer
0986 768 834
sales@labvietchem.com.vn

Lưu Vân Quỳnh
Trưởng nhóm sinh hóa
0367 631 984
sales@labvietchem.com.vn

Phan Hải Phong
Sales Engineer
0949 966 821
sales@labvietchem.com.vn

Dương Tuấn Anh
Sales Engineer
0329 422 268
sales@labvietchem.com.vn

Hotline
Hóa chất và thiết bị thí nghiệm
0826 050 050
saleadmin806@vietchem.vn

Hồ Thị Hoài Thương
Sales Engineer
0967 609 897
kd801@labvietchem.vn

Phạm Thị Nhật Hạ
Sales Engineer
0985 357 897
kd803@vietchem.vn

Vũ Thị Kim Khánh
Sales Engineer
0965 948 897
kd802@vietchem.vn

Nguyễn Hoàng Giáo
Sales Engineer
0939 154 554
kd201@labvietchem.com.vn

Tạ Thảo Cương
Sales Engineer
0888851646
kd205@labvietchem.vn

Trần Thị Trúc Lil
Sales Engineer
0325 300 716
kd202@labvietchem.com.vn

Trần Dương Thanh
Nhân viên kinh doanh
0964980951
saleadmin201@labvietchem.vn
Nhận xét đánh giá