Trong hoá học có phân chia thành oxit, axit, bazo, oxit axit, oxit bazo. Mỗi loại đều sẽ có các đặc điểm, tính chất khác nhau. Như hôm trước chúng ta tìm hiểu oxit là gì, thì hôm nay mời mọi người cùng theo dõi bài viết của LabVIETCHEM để tìm hiểu về khái niệm oxit bazo là gì? Tính chất, đặc điểm của oxit bazo nhé.
Oxit bazơ là hợp chất gồm một hay nhiều nguyên tử kim loại kết hợp với một hay nhiều nguyên tử oxy và có bazơ tương ứng. Các oxit bazơ tan được trong nước gồm các kim loại kiềm như Na, K, Li...và kim loại kiềm thổ như Ba, Ca, Mg... ngoại trừ Be.

Tìm hiểu Oxit bazo là gì?
Phân loại:
- Oxit bazơ tan là oxit bazơ của các bazơ kiềm hoặc bazơ kiềm thổ
- Oxit bazơ không tan là oxit bazơ của các kim loại còn lại như Fe, Cu... và các oxit khác kiềm.
Ngoài ra còn có oxit lưỡng tính và oxit trung tính:
- Oxit lưỡng tính là những oxit tác dụng với các dung dịch axit và tác dụng với dung dịch bazo tạo thành muối và nước. Ví dụ như Al2O3, ZnO...
- Oxit trung tính là những oxit không phản ứng với nước để tạo ra axit hay bazơ, không phản ứng với bazơ hay axit để tạo muối. Ví dụ như CO, NO...
- Tên oxit: tên nguyên tố cộng oxit
Ví dụ: NO là Nito oxit, BaO là Bari oxit

Cách đọc tên oxit bazo
- Nếu kim loại có hóa trị như Fe hoá trị II, III thì tên gọi sẽ là tên kim loại kèm hóa trị + oxit.
Ví dụ cụ thể như sau: FeO đọc là Sắt II oxit, Fe2O3 đọc là Sắt III oxit
- Nếu phi kim có nhiều hoá trị:
Tên oxit sẽ được đọc là tên phi kim (có tiền tố chỉ số nguyên tử phi kim) + oxit (có tiền tố chỉ nguyên tố oxit)
Chỉ có oxit bazơ của kim loại kiềm và kiềm thổ là tác dụng được với nước. Những oxit bazơ tác dụng với nước là: K2O, Na2O, CaO, BaO, Li2O, Rb2O, SrO...
Công thức chung được thể hiển dưới đây:
R2On + nH2O -> 2R(OH)n
n là hóa trị của kim loại R
R(OH)n là chất tan trong nước, dung dịch thu được ta gọi chung là dung dịch bazơ hay dung dịch kiềm dung dịch bazơ tan. Các dung dịch bazơ này thường làm cho giấy quỳ tím chuyển sang màu xanh và làm phenolphtalein từ không màu chuyển sang màu hồng.
K2O + H2O -> 2KOH
Na2O + H2O -> 2NaOH
BaO + H2O -> Ba(OH)2
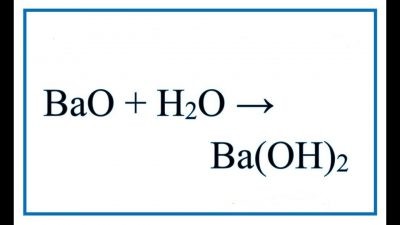
Oxit bazo tác dụng với nước tạo thành dung dịch bazo
Hầu hết các oxit bazơ tác dụng với axít tạo thành muối và nước hầu hết các oxit bazơ đều tác dụng được
Công thức chung được thể hiện dưới đây:
Oxit bazo + axit -> Muối + H2O
Ví dụ ta có phương trình phản ứng như sau:
BaO + 2HCl -> BaCl2 + H2O
Fe2O3 + 3H2SO4 -> Fe(SO4)3 + H2O
Một số oxit bazơ tác dụng với oxit axít tạo thành muối. Thông thường đó là các oxit tác dụng được với nước, có thể nói là tan được trong nước.
Công thức được viết như sau:
Oxit bazo + oxit axit -> Muối
Ví dụ với các phương trình phản ứng sau:
CaO + CO2 -> CaCO3
BaO + SO4 -> BaSO3

Các bài tập về oxit bazo
Bước 1: Gọi tên công thức oxit bazơ cần tìm rượu vào kim loại để bày cho, hoặc đề bài chưa cho biết kim loại
Bước 2: Tính toán các số mối liên quan
Bước 3: Dựa vào kết quả thu được viết phương trình hóa học
Bước 4: Lập phương trình hóa học dựa vào các phân số theo cách đặt
Ví dụ: Cho 4,48 gam một oxit của kim loại hóa chị hai tác dụng hết với 7,84 gam axit sunfuric H2SO4. Sau đó, xác định công thức của oxit trên.
Hướng dẫn cách giải chi tiết
Gọi tên của oxit cần tìm là MO vì kim loại có hoá trị II
n(H2SO4)= 0,08 mol, n(MO) = 4,48 (M + 16)
Ta có phương trình:
MO + H2SO4 -> MSO4 + H2O
Theo đề bài: 4,48 (M + 16) 0,08 mol
Suy ra: 4,48g ( M + 16) = 0,08 => M = 40
Là Ca vậy oxit cần tìm là CaO.
Trường hợp 1:
Oxit bazơ + dung dịch H2SO4 axit sunfuric loãng -> Muối sunfat + nước
Ví dụ:
Na2O + H2SO4 -> Na2SO4 + H2O
Nhận xét: Các phản ứng hóa học trên có điểm giống nhau là: Khi chuyển từ oxit thành muối sunfat thì cứ một mol axit sunfuric than gia phản ứng thì khối lượng muối tăng. Từ đó ta có công thức:
R + 16 gam -> (R + 96) gam -> 1 mol H2O sinh ra hoặc 1 mol H2SO4 tham gia phản ứng. Từ đó ta có công thức:
Muối sunfat = m(oxit) + 80n H2SO4
Hy vọng với những thông tin của labvietchem.com.vn vừa rồi đã giúp cho các bạn hiểu thêm về oxit bazơ là gì cũng như là các công thức viết chung, cách đọc tên, tính chất và các dạng bài tập của oxit bazơ này. Hãy comment nếu có thắc mắc để được giải đáp nhé.
Hỗ trợ

Tống Duy Cương
Director
0915 989 780
DuyCuong@labvietchem.vn

Nguyễn Văn Trọng
Deputy Director
094 6688 777
trongnguyen@labvietchem.vn

Cao Thu Hoài
Sales Engineer
0325 290 685
thietbi404@labvietchem.vn

Nguyễn Thúy Hảo
Sales Engineer
0364 841 980
nguyenhao@labvietchem.com.vn

Trần Thị Kim Mỵ
Sales Engineer
0348 140 389
sales@labvietchem.com.vn

Trịnh Văn Hường
Sales Engineer
0986 768 834
sales@labvietchem.com.vn

Lưu Vân Quỳnh
Trưởng nhóm sinh hóa
0367 631 984
sales@labvietchem.com.vn

Phan Hải Phong
Sales Engineer
0949 966 821
sales@labvietchem.com.vn

Dương Tuấn Anh
Sales Engineer
0329 422 268
sales@labvietchem.com.vn

Hotline
Hóa chất và thiết bị thí nghiệm
0826 050 050
saleadmin806@vietchem.vn

Hồ Thị Hoài Thương
Sales Engineer
0967 609 897
kd801@labvietchem.vn

Phạm Thị Nhật Hạ
Sales Engineer
0985 357 897
kd803@vietchem.vn

Vũ Thị Kim Khánh
Sales Engineer
0965 948 897
kd802@vietchem.vn

Nguyễn Hoàng Giáo
Sales Engineer
0939 154 554
kd201@labvietchem.com.vn

Tạ Thảo Cương
Sales Engineer
0888851646
kd205@labvietchem.vn

Trần Thị Trúc Lil
Sales Engineer
0325 300 716
kd202@labvietchem.com.vn

Trần Dương Thanh
Nhân viên kinh doanh
0964980951
saleadmin201@labvietchem.vn
Nhận xét đánh giá